Coccidiosis en rumiantes una infección inevitable

La coccidiosis es una enfermedad causada por protozoos gastrointestinales del género Eimeria, comúnmente llamados coccidios.
 La prevalencia de la coccidiosis en rumiantes es elevada y puede llegar a afectar hasta el 100% de los terneros1,3,4,5.
La prevalencia de la coccidiosis en rumiantes es elevada y puede llegar a afectar hasta el 100% de los terneros1,3,4,5.
| La probabilidad de que un animal infectado desarrolle signos clínicos dependerá de…
…por lo que el impacto de la enfermedad puede parecernos menor de lo que es en realidad. |
 Los ooquistes de los coccidios son ubicuos en el ambiente y muy resistentes por lo que, tarde o temprano, los terneros, corderos o cabritos acaban infectados1, lo que implica que la infección por especies patógenas de Eimeria es prácticamente inevitable en muchos casos1.
Los ooquistes de los coccidios son ubicuos en el ambiente y muy resistentes por lo que, tarde o temprano, los terneros, corderos o cabritos acaban infectados1, lo que implica que la infección por especies patógenas de Eimeria es prácticamente inevitable en muchos casos1.
IMPACTO ECONÓMICO DE LAS COCCIDIOSIS 
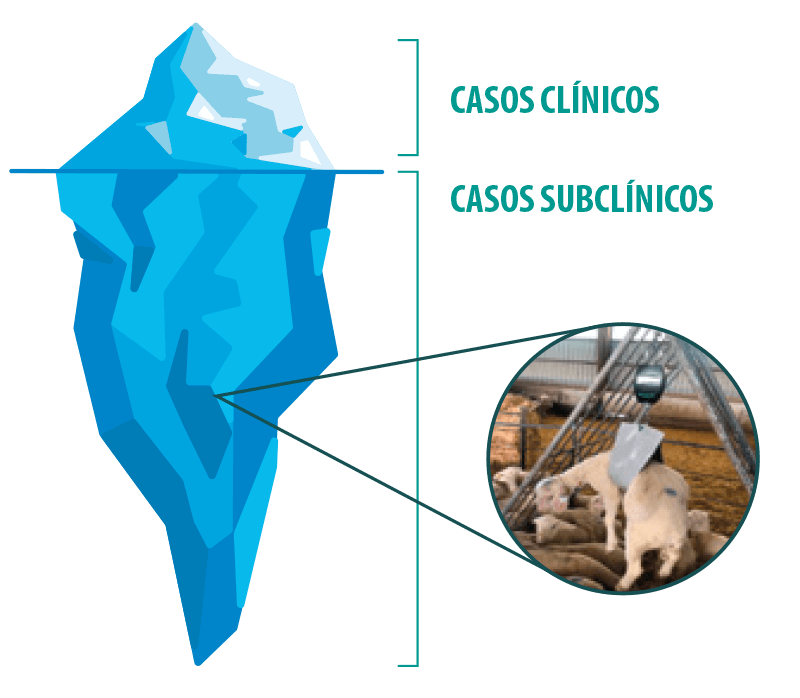
El impacto económico de la coccidiosis es elevado. Las pérdidas asociadas a los casos clínicos son evidentes (bajas, tratamientos, etc.).
En cambio, las pérdidas debidas a los casos subclínicos, mucho más cuantiosas, suelen ser menos visibles (peores índices de conversión asociados a las lesiones intestinales producidas por el parásito). Además, los animales afectados presentan una mayor susceptibilidad a infecciones secundarias y patologías subsiguientes.
 Por ejemplo, los corderos que sufren coccidiosis presentan 2,12 veces más riesgo de sufrir neumonías13.
Por ejemplo, los corderos que sufren coccidiosis presentan 2,12 veces más riesgo de sufrir neumonías13.
EL CICLO VITAL DE EIMERIA 
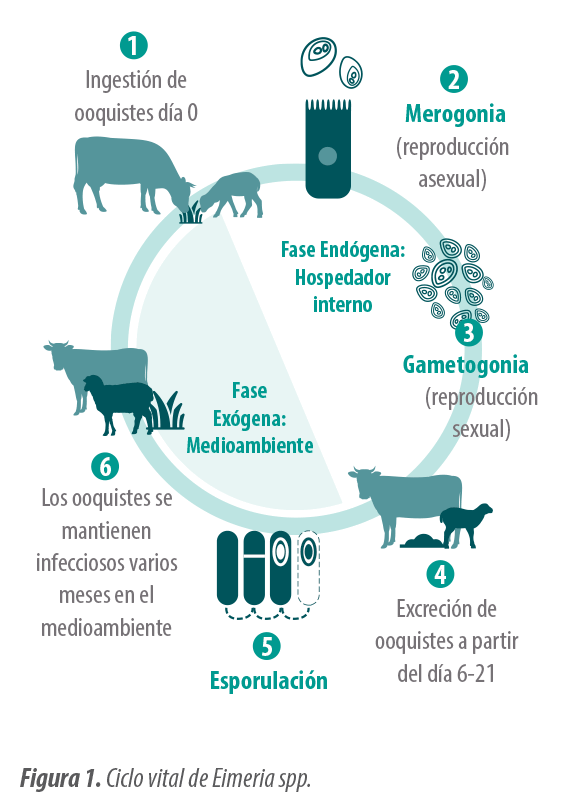
Desarrollar un adecuado plan de control requiere un buen conocimiento del ciclo vital de Eimeria que se divide en dos fases (Figura 1).
 La fase exógena tiene lugar en el ambiente, mientras que la fase endógena tiene lugar en el hospedador. Si bien, la duración del ciclo es variable según la especie, suele completarse entre 2-4 semanas6.
La fase exógena tiene lugar en el ambiente, mientras que la fase endógena tiene lugar en el hospedador. Si bien, la duración del ciclo es variable según la especie, suele completarse entre 2-4 semanas6.


CARACTERÍSTICAS EPIDEMIOLÓGICAS DE LOS COCCIDIOS 
Los coccidios son muy prolíficos, ya que un ooquiste esporulado puede llegar a producir la eliminación de 23 millones de ooquistes6. Esto se traduce en grandes niveles de contaminación en el ambiente, lo que favorece la diseminación de la enfermedad1.
 Los animales del mismo grupo normalmente están expuestos a una carga similar de infección por Eimeria y a los mismos factores de manejo y estrés, además de vivir en el mismo entorno1. Por consiguiente, todo el grupo se considera infectado, sea de forma clínica o subclínica. De hecho, más que una enfermedad que afecta a algunos animales, la coccidiosis se considera una enfermedad de rebaño o de lote. Los animales del mismo grupo normalmente están expuestos a una carga similar de infección por Eimeria y a los mismos factores de manejo y estrés, además de vivir en el mismo entorno1. Por consiguiente, todo el grupo se considera infectado, sea de forma clínica o subclínica. De hecho, más que una enfermedad que afecta a algunos animales, la coccidiosis se considera una enfermedad de rebaño o de lote.
|
Los animales de más edad actúan como reservorios de la enfermedad, eliminando ooquistes al ambiente, aunque son los animales jóvenes la principal fuente de diseminación, al excretar millones de ooquistes.
A partir del año, los animales desarrollan inmunidad y solo excretan pequeñas cantidades. Sin embargo, las madres pueden incrementar la eliminación de ooquistes en el preparto siendo origen de la infección de los neonatos.
![]() Los ooquistes son extremadamente resistentes en el medioambiente y pueden mantenerse viables hasta un año5.
Los ooquistes son extremadamente resistentes en el medioambiente y pueden mantenerse viables hasta un año5.
FISIOPATOLOGÍA E INMUNIDAD FRENTE A LA COCCIDIOSIS 
TERNEROS 
Los terneros de tres semanas a seis meses de edad son los más susceptibles a los efectos de la enfermedad5. E. bovis y E. zuernii La gran destrucción del epitelio distal del intestino delgado y del intestino grueso produce hemorragias y enteritis, por lo que, en las infecciones por E. bovis y E. zuernii, con frecuencia se observan diarrea hemorrágica y tenesmo. E. alabamensis E. alabamensis es, sin embargo, moderadamente patógeno y suele provocar diarrea acuosa5. |
CORDEROS 
Los corderos de cuatro semanas a seis meses de edad son los más susceptibles al daño intestinal6. En el ganado ovino, las infecciones mixtas son más frecuentes, pudiendo ser grave, aunque la dosis infectiva sea moderada. E. bakuensis La lesión más comúnmente asociada a E. bakuensis es la formación de pólipos en el intestino delgado resultado de la replicación del parásito. E. ovinoidalis E. ovinoidalis puede inducir una enteritis grave y mortal poco después de la infección durante las fases asexuales de replicación5. |
Para el desarrollo de inmunidad frente a Eimeria, es necesaria la infección con una cantidad suficiente de ooquistes1.
 La inmunidad protege frente las manifestaciones clínicas de la enfermedad, pero no suprime completamente la replicación del parásito en caso de una posterior exposición2. Además, al no haber protección cruzada entre especies, es posible que los animales padezcan la enfermedad más de una vez.
La inmunidad protege frente las manifestaciones clínicas de la enfermedad, pero no suprime completamente la replicación del parásito en caso de una posterior exposición2. Además, al no haber protección cruzada entre especies, es posible que los animales padezcan la enfermedad más de una vez.

DIAGNÓSTICO DE LAS COCCIDIOSIS 
Los factores clave para el diagnóstico de las coccidiosis en rumiantes incluyen:
![]() Conocimiento del historial de la explotación
Conocimiento del historial de la explotación
![]() Conocimiento de los signos clínicos y edad de los animales afectados
Conocimiento de los signos clínicos y edad de los animales afectados
![]() Buena interpretación de los análisis coprológicos
Buena interpretación de los análisis coprológicos
Signos clínicos
Normalmente, sospecharemos de coccidiosis en base al historial de la explotación y los signos clínicos.
La edad es un factor determinante a tener en cuenta ya que, debido a la duración del periodo de prepatencia, raramente afectará a animales de menos de tres semanas de edad, lo que permite distinguirlo de otras causas de diarrea neonatal2.
Los signos clínicos de las coccidiosis incluyen2,6:
![]() Diarrea (a veces hemorrágica con sangre digerida o sin digerir, según la ubicación de las lesiones intestinales)
Diarrea (a veces hemorrágica con sangre digerida o sin digerir, según la ubicación de las lesiones intestinales)
![]() Anorexia
Anorexia
![]() Dolor abdominal
Dolor abdominal
![]() Dificultad para defecar y prolapso rectal
Dificultad para defecar y prolapso rectal
![]() Deshidratación, depresión y palidez de las membranas mucosas
Deshidratación, depresión y palidez de las membranas mucosas
 En terneros, de forma infrecuente, pueden darse casos de coccidiosis nerviosa de alta mortalidad, con aparición de temblores musculares, convulsiones y nistagmo.
En terneros, de forma infrecuente, pueden darse casos de coccidiosis nerviosa de alta mortalidad, con aparición de temblores musculares, convulsiones y nistagmo.
Análisis coprológico
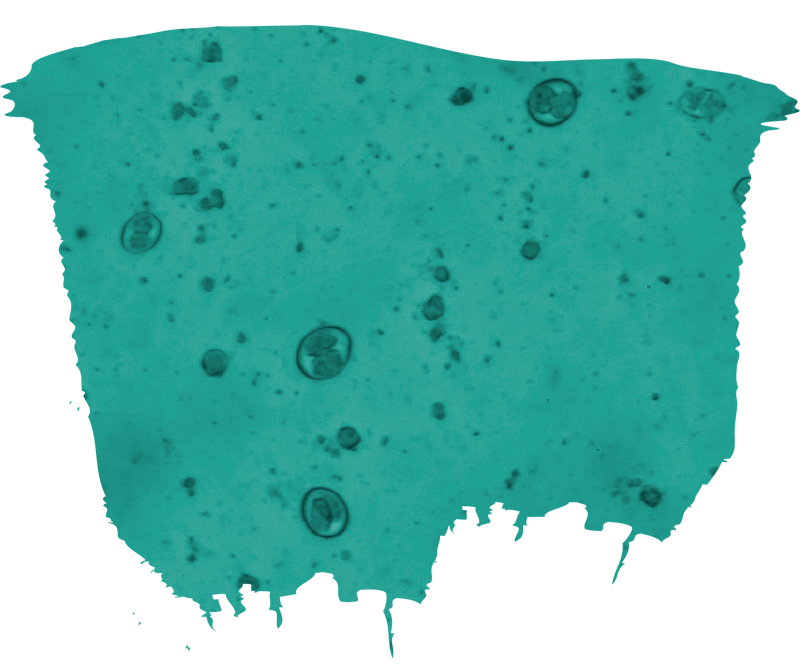
A la hora de confirmar el diagnóstico, identificar la presencia de ooquistes de coccidios patógenos en las heces es clave1.

![]() Puede ser interesante identificar la especie involucrada, debido al gran número de especies no patógenas1.
Puede ser interesante identificar la especie involucrada, debido al gran número de especies no patógenas1.
TOMA DE MUESTRAS
A la hora de tomar las muestras, debemos tener en cuenta que la excreción de ooquistes es muy variable a lo largo del ciclo.
 Fases muy tempranas o tardías pueden dar lugar a falsos negativos, ya que el cuadro clínico puede aparecer antes o prolongarse más allá del período de la eliminación de ooquistes.
Fases muy tempranas o tardías pueden dar lugar a falsos negativos, ya que el cuadro clínico puede aparecer antes o prolongarse más allá del período de la eliminación de ooquistes.
 La mayor excreción de ooquistes se produce al inicio del periodo de patencia, por lo que el momento óptimo para recoger las muestras será al inicio de la diarrea. Otra opción, será muestrear varios animales afectados del grupo en distintas fases.
La mayor excreción de ooquistes se produce al inicio del periodo de patencia, por lo que el momento óptimo para recoger las muestras será al inicio de la diarrea. Otra opción, será muestrear varios animales afectados del grupo en distintas fases.
Necropsia
La necropsia también puede ser útil, siendo la hemorragia intestinal y las manchas blanquecinas-grisáceas en la mucosa signos típicos de coccidiosis. La histopatología puede tener un valor confirmatorio6.

CONTROL DE LAS COCCIDIOSIS 
¡La prevención es clave para el control de las coccidiosis!
Dado que la infección se produce por vía fecal-oral, las estrategias de manejo encaminadas a reducir la contaminación fecal del alimento y agua, en combinación con una buena higiene, reducirán el riesgo de enfermedad2.
Los desinfectantes a base de peróxidos, aminas, cresol o clorocresol son eficaces contra los ooquistes de Eimeria.
![]() No obstante, muchos productos quedan inactivados en presencia de materia orgánica, por lo que un requisito esencial para una buena desinfección es la limpieza física previa, lo que puede ser difícil en muchas instalaciones.
No obstante, muchos productos quedan inactivados en presencia de materia orgánica, por lo que un requisito esencial para una buena desinfección es la limpieza física previa, lo que puede ser difícil en muchas instalaciones.
 La exposición a la luz solar también reduce la supervivencia de los ooquistes5,6.
La exposición a la luz solar también reduce la supervivencia de los ooquistes5,6.
Los esfuerzos en materia de higiene para eliminar o reducir la contaminación fecal tienen un éxito limitado1,2,5. En especies de alta patogenicidad, pequeñas dosis infectivas pueden causar enfermedad, y como el parásito es muy prolífico, la recontaminación tiene lugar rápidamente.
 Por ello, administrar un tratamiento metafiláctico de forma puntual en los animales de los grupos afectados puede ser recomendable a fin de cortar el ciclo de replicación del parásito1,2,5,6.
Por ello, administrar un tratamiento metafiláctico de forma puntual en los animales de los grupos afectados puede ser recomendable a fin de cortar el ciclo de replicación del parásito1,2,5,6.
 Dado que los brotes de coccidiosis clínica son un problema de rebaño que se acelera con el estrés, minimizar los factores de riesgo (transporte, mezcla de animales, destetes bruscos, cambios de alimentación y hacinamiento) será clave para reducir el riesgo de enfermedad5,6. Dado que los brotes de coccidiosis clínica son un problema de rebaño que se acelera con el estrés, minimizar los factores de riesgo (transporte, mezcla de animales, destetes bruscos, cambios de alimentación y hacinamiento) será clave para reducir el riesgo de enfermedad5,6. |
Opciones farmacológicas
En el pasado, se realizaban tratamientos profilácticos para el control de coccidios. Sin embargo, las restricciones al tratamiento profiláctico con antimicrobianos de la Nueva Normativa Europea de Medicamentos Veterinarios (UE 2019/6), nos llevan en la actualidad a dos posibles enfoques a la hora de combatir la coccidiosis:
![]() Metafiláctico
Metafiláctico
![]() Terapéutico
Terapéutico
La metafilaxia es claramente la más recomendable, dado que el enfoque terapéutico no controla las infecciones subclínicas y llegamos tarde en los casos clínicos, una vez que el parásito ya ha producido el daño1,6. En caso de aplicar metafilaxia deberemos contar con la justificación adecuada (Figura 2).

 El objetivo del tratamiento metafiláctico consiste en controlar el impacto del parásito en el grupo una vez hemos diagnosticado la enfermedad en el rebaño.
El objetivo del tratamiento metafiláctico consiste en controlar el impacto del parásito en el grupo una vez hemos diagnosticado la enfermedad en el rebaño.
 En el caso de tratamientos de dosis única, éste debe aplicarse durante el período inicial de la infección. Así, evitamos la replicación del parásito y reducimos la excreción de ooquistes.
En el caso de tratamientos de dosis única, éste debe aplicarse durante el período inicial de la infección. Así, evitamos la replicación del parásito y reducimos la excreción de ooquistes.
compuestos derivados de las triazinas, como el diclazurilo y el toltrazurilo, actúan en varias fases del ciclo de replicación de los coccidios1.
Una dosis única en el momento adecuado (aproximadamente una semana antes del brote esperado de coccidiosis) puede controlar eficazmente la enfermedad. Sin embargo, si el periodo de riesgo se prolonga en el tiempo, puede ser necesario aplicar un segundo tratamiento1,2,5,6.
 En el caso del toltrazurilo es importante revisar en el prospecto las posibles restricciones de uso según tipo de producción y peso debidas a motivos medioambientales
En el caso del toltrazurilo es importante revisar en el prospecto las posibles restricciones de uso según tipo de producción y peso debidas a motivos medioambientales
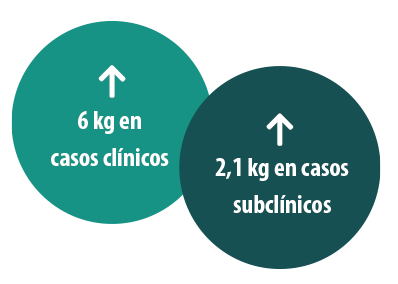
 A modo de ejemplo de la eficacia del tratamiento metafiláctico, un estudio14 analizó el impacto del tratamiento metafiláctico con diclazurilo 1 mg/kg en terneros (Vecoxan®, MSD AH) sobre los casos clínicos y subclínicos, evidenciando una reducción importante de la excreción de ooquistes y, lo que es más importante, un incremento de la ganancia de peso con respecto a los animales del grupo control sin tratar. A modo de ejemplo de la eficacia del tratamiento metafiláctico, un estudio14 analizó el impacto del tratamiento metafiláctico con diclazurilo 1 mg/kg en terneros (Vecoxan®, MSD AH) sobre los casos clínicos y subclínicos, evidenciando una reducción importante de la excreción de ooquistes y, lo que es más importante, un incremento de la ganancia de peso con respecto a los animales del grupo control sin tratar.
El momento óptimo para empezar el tratamiento es en fases iniciales de la infección, de forma que haya tiempo para que se establezca inmunidad y para prevenir el desarrollo completo del parásito y las lesiones intestinales1,2,5. De hecho, un estudió15 determinó cómo el tratamiento con diclazurilo 1mg/kg (Vecoxan®, MSD AH) controlaba la coccidiosis al tiempo que permitía el desarrollo de inmunidad natural que protegía a los animales de futuras reinfecciones en caso de gran presión de infección. |
 Dada la imposibilidad de que los ooquistes puedan eliminarse completamente del ambiente, un enfoque multimodal que combine buenas prácticas zootécnicas junto a tratamientos metafilácticos puntuales cuando sea necesario (en la ventana de riesgo de la enfermedad), constituyen una estrategia práctica y eficaz a la hora de controlar la coccidiosis.
Dada la imposibilidad de que los ooquistes puedan eliminarse completamente del ambiente, un enfoque multimodal que combine buenas prácticas zootécnicas junto a tratamientos metafilácticos puntuales cuando sea necesario (en la ventana de riesgo de la enfermedad), constituyen una estrategia práctica y eficaz a la hora de controlar la coccidiosis.
“En caso de duda, consulte a su veterinario”? (y el link a la FT):
VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS – 1309 ESP – Ficha técnica (aemps.es)
BIBLIOGRAFÍA:
1. Daugschies A., Najdrowski M. Eimeriosis in Cattle: Current Understanding. J. Vet. Med. B 52, 417–427 (2005)
2. Jolley W., Bardsley K. Ruminant Coccidiosis. Vet Clin Food Anim 22 (2006) 613–621
3. Fox, J. E., Coccidiosis in cattle. Mod. Vet. Pract. 1985: 66, 113–116
4. Grafner, G. Further studies on the occurrence, epizootiology and control of Eimeria coccidiosis in cattle under the conditions of intensive stable housing. Mh. Vet. -Med. 40, 41–44 (1985)
5. Bangoura B., Bardsley K. Ruminant Coccidiosis. Vet Clin Food Anim 36 (2020) 187–203
6. Keeton S., Navarre C. Coccidiosis in Large and Small Ruminants. Vet Clin Food Anim 34 (2018) 201–208
7. Marquardt W. Effect of high temperature on sporulation of Eimeria zuernii. Exp Parasitol 1960; 10:58–65.
8. Faber, J., D. Kollmann, A. Heise, C. Bauer, K. Failing, H. J. Bürger, and H. Zahner. Eimeria infections in cows in the periparturient phase and their calves: oocyst excretion and levels of specific serum and colostrum antibodies. Vet. Parasitol. 2002: 106, 1–17.
9. Burger, H., Eimeria infections in cattle. Berl. Münich. Veterinarian weekly 1983: 96, 350–357.
10. Chartier, C., Pellet, M.P., Pors, I., 1992. Effects of toltrazuril on oocyst discharge and growth in kids with naturally-acquired coccidial infections. Small Rumin. Res. 8, 171–177.
11. Chartier, C., Pors, I., 2000. Efficacité du diclazuril sur l’excrétion d’oocystes de coccidies chez la chevrette: détermination de la posologie active. Bull G.T.V. 9, 211–214.
12. Ruiz, A., Guedes, A.C., Muñoz, M.C., Molina, J.M.,Martín, S., Hernández, Y. I., Hernández, Á., Pérez, D., Matos, L., López, A. M., 2012. Control strategies using diclazuril against coccidiosis in goat kids Parasitology Research 110:2131–2136 DOI 10.1007/s00436-011-2746-0
13. González, J.M., Bello, J., Rodríguez, M., Navarro, T., Lacasta, D., Fernández, A., De lasHeras, M., 2016. Lamb feedlot production in Spain: most relevant health issues. Small Ruminant Research 142, 83–87.
14. Gradwell D., Agneessens J., Coossens L., Veys P. 2005. Efficacy of Diclazuril (VecoxanTM) Against Naturally Acquired Eimeria Tnfections in Suckling Calves and Economic Benefits of Treat meat. Cattle Practice Vol 13, 231-234.
15. Taylor M.A., Marshall R.N., Marshall J.A., Catchpolea J. y Bartram D., 2011. Dose–response effects of diclazuril against pathogenic species of ovine coccidia and the development of protective immunity. Veterinary Parasitology 178, 48-57





 Latinoamérica
Latinoamérica
 Europa
Europa