Etiología y diagnóstico de mamitis en el ganado bovino
La mamitis es la enfermedad más común y una de las que más costes genera en el ganado vacuno lechero.
Se trata de una reacción inflamatoria de la glándula mamaria que lleva consigo un cambio en la composición de la leche debido, en la mayoría de los casos, a una infección por agentes patógenos.
Según los signos observados, las mamitis se clasifican en:
- Mamitis clínicas: cuando se produce alteración en la leche.
- Mamitis subclínicas: cuando no hay alteración macroscópica de la misma (Gráfico 1) (C. Pinzon-Sánchez et al., 2011).
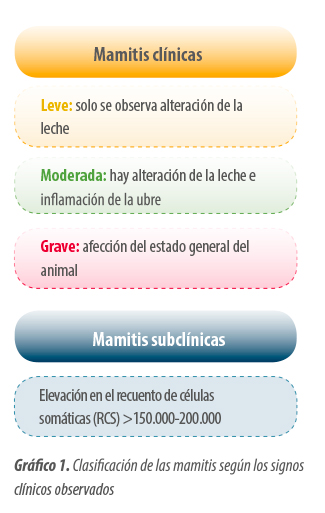
Las mamitis subclínicas son las que más preocupan a día de hoy a ganaderos y veterinarios, ya que producen un aumento de células somáticas en el tanque que puede conllevar penalizaciones en la recogida y venta de la leche.
Estas patologías tienen un origen infeccioso en la mayor parte de los casos. El tratamiento y pronóstico de la enfermedad varía en función del agente etiológico, por ello, se debe realizar un diagnóstico laboratorial completo que permita establecer la causa del problema y recuperar cuanto antes la producción de leche.
En función de la etiología, las mamitis se diferencian en:
- Mamitis ambientales: el agente causal se encuentra en el ambiente y no necesita al animal para persistir.
- Mamitis contagiosas: los agentes infecciosos necesitan la ubre para sobrevivir, no siendo viables en el ambiente por mucho tiempo (Gráfico 2).

Cuando hay problemas de mamitis en una explotación se deberán tomar muestras de leche de una manera adecuada para realizar un diagnóstico concluyente. Estas pueden ser tanto de animales individuales con presencia de mamitis clínica o subclínica, como muestras del tanque.
Para la selección de los animales a muestrear existen diversos métodos como:
- Californian Mastitis Test (CMT)
- Palpación de las ubres
- Recuento de células somáticas (RCS)
- Medición de la conductividad eléctrica en la leche
El muestreo del tanque permite la detección de agentes infecciosos, prever potenciales procesos patológicos y la monitorización de diversas enfermedades en la explotación (Quist et al., 2008; Hortet y Seegers, 1998).
En granja es posible realizar un diagnóstico con kits comerciales mediante el cultivo de las muestras de leche.
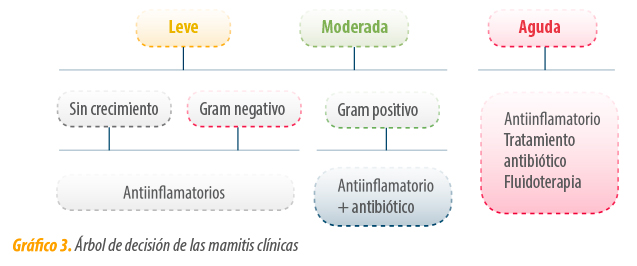
Estas pruebas generalmente diferencian cultivos negativos y detectan la presencia de bacterias Gram + o Gram –. Con ello se obtiene un diagnóstico precoz que permite orientar el tratamiento (Gráfico 3).
Estos sistemas presentan limitaciones ya que no identifican la presencia de algunos gérmenes como Mycoplasma spp., Prototheca spp. o levaduras.
Para un diagnóstico más exhaustivo se recomienda enviar muestras al laboratorio donde se pueden realizar diferentes pruebas diagnósticas:
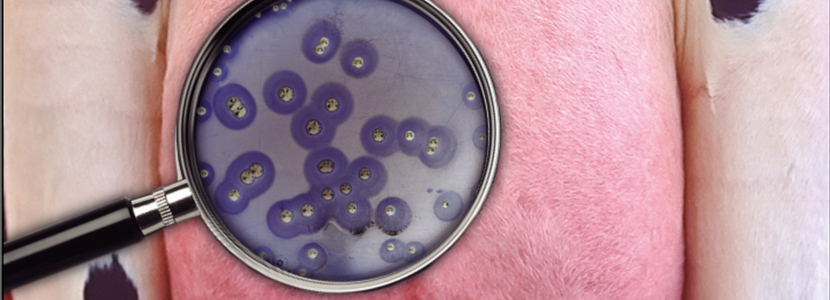
- Cultivo microbiológico: mediante la siembra de las muestras de manera individual se obtienen las cepas bacterianas causantes del problema de mamitis (Imagen 1).
- Estudios de sensibilidad antibiótica de las cepas aisladas, tanto por el método de Kirby-Bauer como por el de Concentración Mínima Inhibitoria (CMI).
- Pruebas moleculares (PCR): se realiza la detección de distintos patógenos o familias causantes de enfermedad por PCR. Asimismo, con la PCR a tiempo real (qPCR) se puede valorar la concentración de patógeno detectado en la muestra.
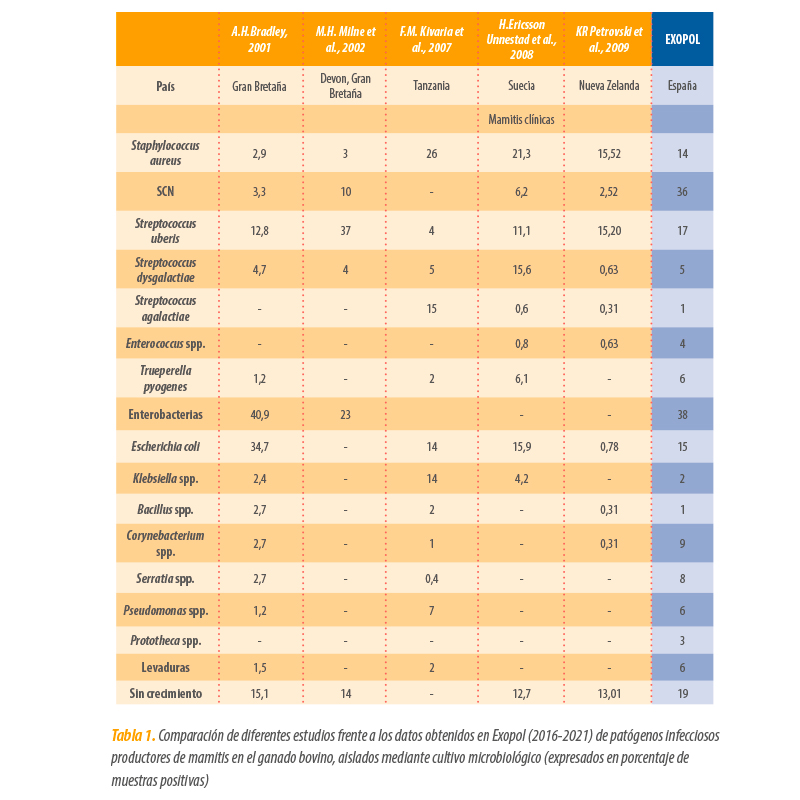
En la Tabla 1 se muestran los resultados expresados en porcentaje de estudios realizados en varios países sobre la etiología de las mamitis en bovino basados en el diagnóstico mediante cultivo microbiológico, así como los resultados obtenidos en EXOPOL a lo largo de 5 años (2016-2021).
En las mamitis clínicas se tomarán diferentes decisiones en función de los resultados obtenidos mediante el diagnóstico y los signos clínicos observados (Gráfico 3) (A. Lago, et al., 2011, C. Pinzón-Sánchez et al., 2011).
El árbol de decisión se basa en las diferencias en el pronóstico y probabilidades de éxito terapéutico que existen, en función del agente etiológico causante de la mamitis.
En el caso de las mamitis subclínicas el protocolo a seguir será el mismo que en las mamitis leves y moderadas. La detección de los animales con mamitis subclínica permite realizar un secado selectivo mediante la inoculación de cánulas de antibiótico en función de los resultados del antibiograma realizado, reduciendo así los animales que serán tratados.
En el caso de Escherichia coli se ha observado una elevada tasa de recuperación (90%) sin tratamiento antibiótico. Por ello, sólo se tratan las que provocan una mamitis clínica grave. Esta patogenicidad depende de la cepa presente y de sus factores de virulencia.
Por otro lado, las especies bacterianas como Streptococcus uberis muestran una buena respuesta al tratamiento pero una baja curación espontánea.
En casos de Staphylococcus aureus, las mamitis son crónicas y de complicado tratamiento. Para ambas especies se ha demostrado que el tratamiento debe ser de instauración temprana y prolongada en el tiempo (5-8 días) (C.Pinzón-Sánchez et al., 2011; Gillespie et al., 2002; Oliver et al., 2003; Deluyker et al., 2005).
Por el contrario, se ha observado que las mamitis producidas por Prototheca spp, Mycoplasma bovis (R.N. González et al., 2003) y levaduras no responden al tratamiento antibiótico, por lo que el control del proceso se basa en mejorar medidas como la limpieza, desinfección, prevención y eliminación de portadores.
CASOS CLÍNICOS
Caso Clínico 1
- Explotación de 150 vacas en ordeño
- La explotación tiene 2 parques con robots de ordeño y realizan predipping y sellado de pezones
- El tratamiento de las mamitis clínicas se realiza con sulfametoxazol-trimetropim, apareciendo casos esporádicos
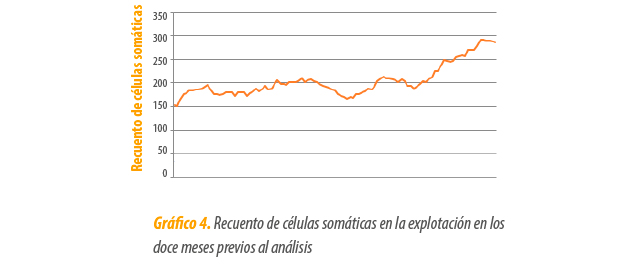
- A lo largo de 5 meses se observa un aumento lineal en el RCS, llegando a alcanzar las 300.000 cél./ml (Gráfico 4)
Por ello, se decide realizar un diagnóstico laboratorial de leche de vacas con mamitis subclínica (aquellas con alteración en la conductividad de la leche, medida con el robot de ordeño) y de vacas con mamitis clínica incipiente, no tratadas.
DIAGNÓSTICO
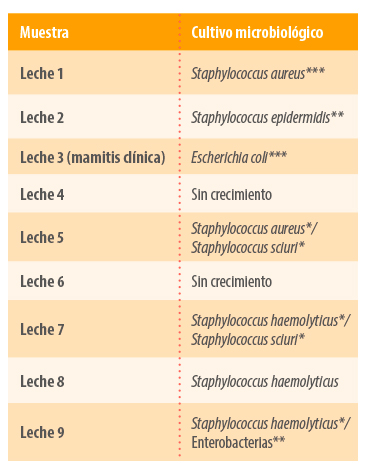
Mediante qPCR se descartó la presencia de agentes como Prothoteca spp. y Mycoplasma bovis en las muestras de leche individuales y en tanque. En esta última muestra se descartó también la presencia de vacas eliminadoras de S. aureus, Streptococcus agalactiae y S. uberis.
INTERPRETACIÓN DE RESULTADOS





 Latinoamérica
Latinoamérica
 Europa
Europa