Primera descripción clinicopatológica de la ictiosis congénita ovina

Este caso representa el primer estudio clinicopatológico de la ictiosis congénita (IC) en la especie ovina.
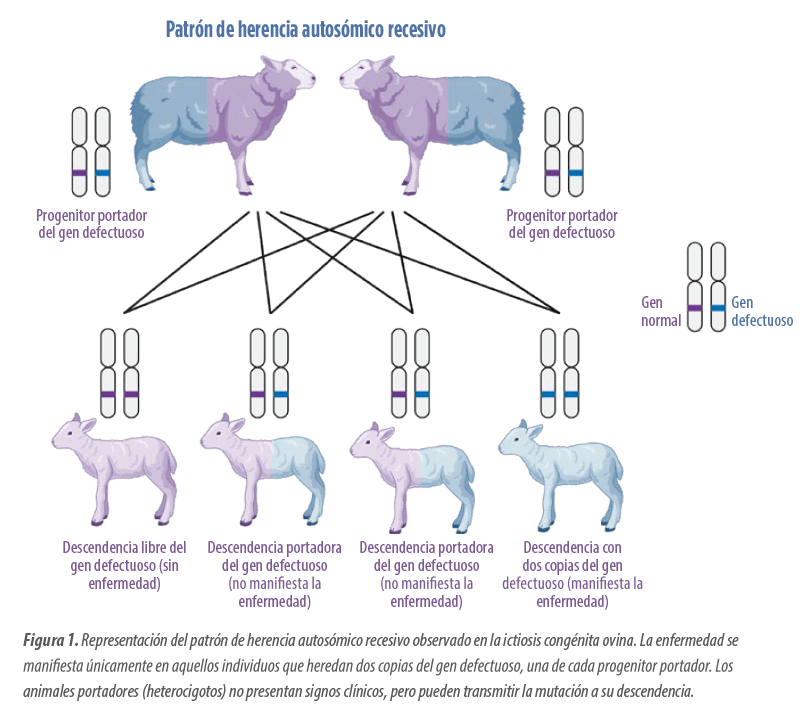
 La IC ovina es una enfermedad genética con un patrón de herencia autosómico recesivo que provoca una hiperqueratosis cutánea de focal a difusa en corderos de 3 a 6 meses de edad.
La IC ovina es una enfermedad genética con un patrón de herencia autosómico recesivo que provoca una hiperqueratosis cutánea de focal a difusa en corderos de 3 a 6 meses de edad.
| Este estudio establece las bases para poder ayudar al diagnóstico temprano de esta enfermedad, así como su posible erradicación en las explotaciones afectadas. |
CASO CLÍNICO
Aparición de lesiones cutáneas en corderos de reposición
En una explotación semi-intensiva de Aragón que cuenta con 2.000 ovejas de raza Rasa Aragonesa, se observó que, cada año, aproximadamente el 2,5 % de los corderos de reposición de 4-6 meses de edad, desarrollaban lesiones cutáneas.
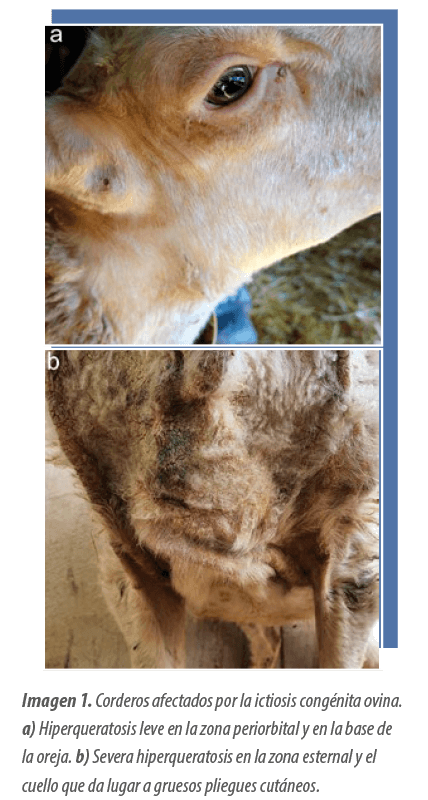
 Estas se caracterizaban por una hiperqueratosis multifocal, que afectaba principalmente al hocico, las zonas periorbitales y el cuello (Imagen 1).
Estas se caracterizaban por una hiperqueratosis multifocal, que afectaba principalmente al hocico, las zonas periorbitales y el cuello (Imagen 1).
 Los animales afectados presentaban una elevada tasa de letalidad, que oscilaba entre el 50 % y el 70 %. Además, se comprobó que la exposición a la luz solar agravaba notablemente la intensidad de estas lesiones.
Los animales afectados presentaban una elevada tasa de letalidad, que oscilaba entre el 50 % y el 70 %. Además, se comprobó que la exposición a la luz solar agravaba notablemente la intensidad de estas lesiones.
Abordaje diagnóstico inicial y diagnóstico diferencial
Basándonos en las lesiones macroscópicas observadas en los animales afectados (Imagen 1) y en el conocimiento de la patología cutánea ovina (Sucupira et al., 2009), se estableció un diagnóstico diferencial, donde incluyeron:
![]() Deficiencias nutricionales de zinc o vitamina A
Deficiencias nutricionales de zinc o vitamina A
![]() Ectoparásitos, como pulgas, ácaros o piojos
Ectoparásitos, como pulgas, ácaros o piojos
![]() Pioderma superficial
Pioderma superficial
![]() Foliculitis bacteriana
Foliculitis bacteriana
![]() Fotosensibilización secundaria
Fotosensibilización secundaria
![]() Ictiosis congénita ovina
Ictiosis congénita ovina
Con el objetivo de alcanzar un diagnóstico definitivo, se llevó a cabo un estudio clinicopatológico en una borrega de 9 meses de edad que presentaba signos compatibles con la enfermedad.
| El animal mostraba un engrosamiento difuso de la piel, acompañado de costras distribuidas por toda la superficie cutánea. Además, se observó una menor densidad de lana, que tenía un aspecto oscuro debido a la presencia de una secreción seborreica. |
Esta hembra fue cruzada, en la propia explotación, con un macho clínicamente sano, lo que dio lugar a un parto doble.
 Ninguno de los corderos resultantes presentó lesiones cutáneas compatibles con la enfermedad.
Ninguno de los corderos resultantes presentó lesiones cutáneas compatibles con la enfermedad.
Posteriormente, el animal fue nuevamente cruzado, esta vez con uno de sus hijos, lo que dio lugar a otro parto doble.
 En esta ocasión, ambos corderos desarrollaron lesiones cutáneas, lo que sugirió un origen genético de la enfermedad, con un patrón de herencia autosómico recesivo.
En esta ocasión, ambos corderos desarrollaron lesiones cutáneas, lo que sugirió un origen genético de la enfermedad, con un patrón de herencia autosómico recesivo.
| A partir de este hallazgo, se inició un seguimiento clínico, hematológico, bioquímico e histopatológico periódico para estudiar la evolución de la enfermedad en estos dos corderos afectados. |
Evolución clínica e histopatológica de la enfermedad
Gracias al seguimiento realizado, fue posible distinguir dos fases en la evolución de la enfermedad.
1. Fase temprana
Aparece entre los 3 y 5 meses de edad y se caracteriza por:

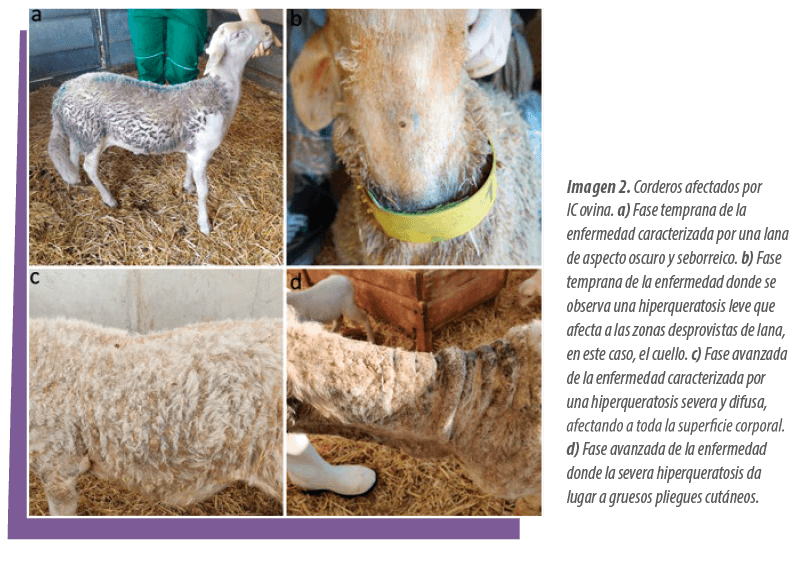
![]() Lana seborreica, oscura y aglomerada (Imagen 2a).
Lana seborreica, oscura y aglomerada (Imagen 2a).
![]() Hiperqueratosis multifocal, bilateral y simétrica, de intensidad leve a moderada, que afecta a las zonas desprovistas de lana, en especial el cuello, el hocico, las áreas periorbitales y las extremidades anteriores (Imagen 2b)
Hiperqueratosis multifocal, bilateral y simétrica, de intensidad leve a moderada, que afecta a las zonas desprovistas de lana, en especial el cuello, el hocico, las áreas periorbitales y las extremidades anteriores (Imagen 2b)
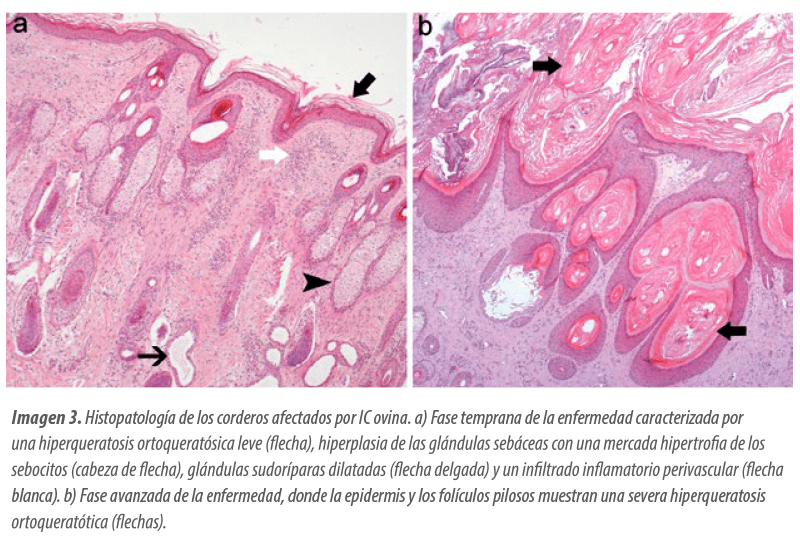
 A nivel microscópico, esta fase se define por una hiperqueratosis ortoqueratótica laminar, difusa y moderada, acompañada de una dermatitis perivascular, linfoplasmocítica y eosinofílica leve (Imagen 3a).
A nivel microscópico, esta fase se define por una hiperqueratosis ortoqueratótica laminar, difusa y moderada, acompañada de una dermatitis perivascular, linfoplasmocítica y eosinofílica leve (Imagen 3a).
2. Fase avanzada
Se desarrolla aproximadamente 6 meses después de la aparición de las primeras lesiones cutáneas.
En este estadío:
![]()
 La hiperqueratosis se extiende a las zonas con lana, llegando a afectar prácticamente toda la superficie corporal (Imagen 2c).
La hiperqueratosis se extiende a las zonas con lana, llegando a afectar prácticamente toda la superficie corporal (Imagen 2c).
![]() La piel muestra pliegues marcadamente engrosados, con fisuras frecuentes y recubiertos por costras gruesas (Imagen 2d).
La piel muestra pliegues marcadamente engrosados, con fisuras frecuentes y recubiertos por costras gruesas (Imagen 2d).
A nivel microscópico, esta fase avanzada se caracteriza por:
![]()
 Hiperqueratosis ortoqueratótica laminar, compacta y de intensidad severa, dispuesta en capas concéntricas que obstruyen la luz de los folículos pilosos, dando lugar en algunos casos a la formación de comedones (Imagen 3b).
Hiperqueratosis ortoqueratótica laminar, compacta y de intensidad severa, dispuesta en capas concéntricas que obstruyen la luz de los folículos pilosos, dando lugar en algunos casos a la formación de comedones (Imagen 3b).
![]() Hiperplasia marcada, tanto en la epidermis como en el epitelio folicular, mientras que las glándulas sebáceas muestran una atrofia severa.
Hiperplasia marcada, tanto en la epidermis como en el epitelio folicular, mientras que las glándulas sebáceas muestran una atrofia severa.
![]() La dermatitis perivascular también se intensifica, adoptando un patrón inflamatorio más grave.
La dermatitis perivascular también se intensifica, adoptando un patrón inflamatorio más grave.
Confirmación del diagnóstico y exclusión de causas nutricionales
Las concentraciones de zinc en el pienso y en el suero de los animales se encontraron en todo momento dentro de los valores de referencia establecidos (Pechin, 2017). Además, se decidió administrar a los animales afectados una inyección intramuscular de óxido de zinc.
 A pesar de esto, las lesiones cutáneas no mostraron ninguna mejoría, lo que permitió descartar de forma definitiva una posible dermatosis por deficiencia de zinc.
A pesar de esto, las lesiones cutáneas no mostraron ninguna mejoría, lo que permitió descartar de forma definitiva una posible dermatosis por deficiencia de zinc.
| Los análisis hematológicos no evidenciaron alteraciones relevantes en los animales afectados. Por tanto, considerando la progresión clínica de la enfermedad, los hallazgos histopatológicos y el origen genético con un patrón de herencia autosómico recesivo, el caso se diagnosticó como una IC ovina. |
DISCUSIÓN: IMPLICACIONES GENÉTICAS Y CLÍNICAS DE UN HALLAZGO INÉDITO EN OVINO
Este estudio constituye el primer caso clínico documentado de ictiosis congénita (IC) en la especie ovina.
 Las ictiosis comprenden un grupo de síndromes hereditarios autosómicos que afectan a la diferenciación terminal de los queratinocitos caracterizados por una hiperqueratosis localizada o generalizada acompañada de descamación, principalmente en zonas con escasa cobertura pilosa o lanosa (Marukian y Choate, 2016).
Las ictiosis comprenden un grupo de síndromes hereditarios autosómicos que afectan a la diferenciación terminal de los queratinocitos caracterizados por una hiperqueratosis localizada o generalizada acompañada de descamación, principalmente en zonas con escasa cobertura pilosa o lanosa (Marukian y Choate, 2016).
 Este grupo de enfermedades ha sido descrito en diversas especies animales, incluyendo ovino, caprino, bovinos, porcino, algunos cánidos, aves de corral e incluso crías de kudú mayor.
Este grupo de enfermedades ha sido descrito en diversas especies animales, incluyendo ovino, caprino, bovinos, porcino, algunos cánidos, aves de corral e incluso crías de kudú mayor.
Se han asociado a mutaciones en múltiples genes implicados en diversas funciones celulares. En medicina veterinaria se reconocen dos formas principales de ictiosis (Mauldin, 2016):
![]() Forma letal o ictiosis epidermolítica (fetalis): se presenta en neonatos con lesiones cutáneas graves y degeneración marcada de los queratinocitos (Marukian y Choate, 2016).
Forma letal o ictiosis epidermolítica (fetalis): se presenta en neonatos con lesiones cutáneas graves y degeneración marcada de los queratinocitos (Marukian y Choate, 2016).
![]() Forma no epidermolítica o congénita (IC): afecta progresivamente a animales jóvenes, con lesiones cutáneas menos severas, compatibles con la vida (Jacinto et al., 2021; Häfliger et al., 2022).
Forma no epidermolítica o congénita (IC): afecta progresivamente a animales jóvenes, con lesiones cutáneas menos severas, compatibles con la vida (Jacinto et al., 2021; Häfliger et al., 2022).
Mientras que la ictiosis fetalis ha sido previamente descrita en ovinos (Câmara et al., 2017), este estudio representa la primera descripción clínica e histopatológica de la forma congénita en esta especie.
| En esta enfermedad se observa un claro patrón de herencia autosómico recesivo que ocurre cuando el animal hereda dos copias defectuosas de un gen (una de cada progenitor) en un cromosoma no sexual, y solo así se manifiesta la enfermedad. No obstante, no se ha identificado aún el gen o genes responsables de esta condición en ovinos. |
Comparativa con otras especies y sospecha génica
Los hallazgos clinicopatológicos descritos en este estudio muestran similitudes con la IC bovina. Sin embargo, en los corderos afectados las lesiones cutáneas aparecen más tarde (alrededor de los 3 meses de edad) en comparación con los bovinos, donde se manifiestan entre las 2 y 10 semanas de vida (Raoofi, 2001; Testoni, Zappulli y Gentile, 2006; Azimpour et al., 2016; Jacinto et al., 2021; Häfliger et al., 2022).
 Esto sugiere que el o los genes implicados en la IC ovina podrían ser distintos de los asociados en bovinos, como FA2H y DSP (Jacinto et al., 2021; Häfliger et al., 2022).
Esto sugiere que el o los genes implicados en la IC ovina podrían ser distintos de los asociados en bovinos, como FA2H y DSP (Jacinto et al., 2021; Häfliger et al., 2022).
Prevención en el rebaño: claves de manejo reproductivo
Para prevenir la aparición de esta enfermedad genética en rebaños ovinos, es imprescindible aplicar medidas básicas de selección genética:
 En el caso de la IC ovina, se debe evitar la reproducción de animales portadores, recomendándose la retirada de individuos heterocigotos identificados como portadores.
En el caso de la IC ovina, se debe evitar la reproducción de animales portadores, recomendándose la retirada de individuos heterocigotos identificados como portadores.
 En ausencia de marcadores genéticos específicos, el análisis retrospectivo de los cruces realizados en la explotación resulta fundamental para identificar al macho o hembra portadores de la mutación.
En ausencia de marcadores genéticos específicos, el análisis retrospectivo de los cruces realizados en la explotación resulta fundamental para identificar al macho o hembra portadores de la mutación.
 Una vez eliminados, se recomienda la incorporación de nuevos reproductores provenientes de otras ganaderías, procurando mantener la mayor diversidad genética posible para minimizar la consanguinidad y, con ello, reducir el riesgo de recurrencia.
Una vez eliminados, se recomienda la incorporación de nuevos reproductores provenientes de otras ganaderías, procurando mantener la mayor diversidad genética posible para minimizar la consanguinidad y, con ello, reducir el riesgo de recurrencia.
Diagnóstico y control: una estrategia basada en evidencias
En conclusión, el diagnóstico definitivo de la IC ovina debe sustentarse en:
![]() Una anamnesis detallada
Una anamnesis detallada
![]() El análisis histopatológico de las lesiones
El análisis histopatológico de las lesiones
![]() La evidencia de un patrón hereditario autosómico recesivo.
La evidencia de un patrón hereditario autosómico recesivo.
Para descartar su principal diagnóstico diferencial, la dermatosis por deficiencia de zinc, es fundamental confirmar niveles séricos adecuados y la ausencia de respuesta a la suplementación con este mineral (Yuzbasiyan-Gurkan et al., 2006; Jung et al., 2014).
| La erradicación de esta enfermedad en explotaciones afectadas requiere identificar y eliminar del plantel reproductor a los animales portadores mediante un estudio genealógico minucioso. |
BIBLIOGRAFÍA
1. Azimpour, S., Sasani, F., Mottaghian, P., Anoushepour, A. 2016. Ichthyosis congenita in a calf: Case report. The Thai Journal of Veterinary Medicine, 46(3), 517–521
2. Câmara, A.C.L., Borges, P.A.C., Paiva, S.A., Pierezan, F., Soto-Blanco, B. 2017. Ichthyosis fetalis in a cross-bred lamb. Veterinary Dermatology, 28, 516-e125. https://doi.org/10.1111/vde.12459
3. Häfliger, I. M., Koch, C. T., Michel, A., Rüfenacht, S., Meylan, M., Welle, M. M., Drögemüller, C. 2022. DSP missense variant in a Scottish Highland calf with congenital ichthyosis, alopecia, acantholysis of the tongue and corneal defects. BMC Veterinary Research 18, 20. https://doi.org/10.1186/s12917-021-03113-3
4. Jacinto, J. G. P., Häfliger, I. M., Veiga, I. M. B., Letko, A., Gentile, A., Drögemüller, C. 2021. A frameshift insertion in FA2H causes a recessively inherited form of ichthyosis congenita in Chianina cattle. Molecular genetics and genomics, 296(6), 1313–1322. https://doi.org/10.1007/s00438-021-01824-8
5. Jung, S., Pausch, H., Langenmayer, M.C., Schwarzenbacher, H., Majzoub Altweck, M., Fries, R. 2014. A nonsense mutation in PLD4 is associated with a zinc deficiency-like syndrome in Fleckvieh cattle. BMC Genomics (15), 623. https://doi.org/10.1186/1471-2164-15-623
6. Marukian, N. V., Choate, K. A. 2016. Recent advances in understanding ichthyosis pathogenesis. F1000Research, 5. https://doi.org/10.12688/f1000research.8584.1
7. Mauldin, E.A., Peters-Kennedy, J. Integumentary system. In: Maxie MG, ed. Jubb, Kennedy, Palmer’s Pathology of Domestic Animals. 6th edition. St. Louis, MO: Elsevier Saunders, 2016; 509–736.
8. Pechin, G. H. 2017. El zinc en la nutrición de los rumiantes. Ciencia Veterinaria, 1 (1), 50-79
9. Raoofi, A. 2001. Ichthyosis congenita in a calf in Iran. The Veterinary record, 149(18), 563. https://doi.org/10.1136/vr.149.18.563
10. Sucupira, M. C. A., Arcaute, M. R. de Lacasta, D., Pérez, M. J., Ramos, J. J., Verde, M. T., Ferrer, L. M. 2009. Enfermedades congénitas y hereditarias de la piel de los corderos (I). Albéitar, (128), 36-37.
11. Testoni, S., Zappulli, V., Gentile, A. (2006). Ichthyosis in two Chianina calves. Deutsche tierarztliche Wochenschrift, 113(9), 351–354.
12. Yuzbasiyan-Gurkan, V., Bartlett, E. 2006. Identification of a unique splice site variant in SLC39A4 in bovine hereditary zinc deficiency, lethal trait A46: An animal model of acrodermatitis enteropathica. Genomics, 88 (4), 521–526. https://doi.org/10.1016/j.ygeno.2006.03.018





 Latinoamérica
Latinoamérica
 Europa
Europa
















































