Tuberculosis en ganado caprino: situación epidemiológica en España y avances en su diagnóstico
SITUACIÓN EPIDEMIOLÓGICA Y PROGRAMAS DE ERRADICACIÓN DE LA TUBERCULOSIS EN GANADO CAPRINO EN ESPAÑA
La tuberculosis animal es una enfermedad zoonósica con grandes implicaciones en sanidad animal y en salud pública que afecta a multitud de animales domésticos y silvestres, entre ellos al ganado caprino.

 Esta especie tiene una gran relevancia como reservorio de tuberculosis en nuestro país, ya que España es el segundo país con mayor censo de ganado caprino tras Grecia y representa el 23% del censo de la Unión Europea1.
Esta especie tiene una gran relevancia como reservorio de tuberculosis en nuestro país, ya que España es el segundo país con mayor censo de ganado caprino tras Grecia y representa el 23% del censo de la Unión Europea1.
No existe un programa de erradicación de tuberculosis en ganado caprino a nivel nacional, pero, dada la importancia de la cabaña ganadera en algunas regiones, algunas Comunidades Autónomas a iniciativa propia han implementado programas regionales obligatorios o voluntarios2.
 Esto conlleva que no existan datos precisos de prevalencia de la enfermedad a nivel nacional en esta especie.
Esto conlleva que no existan datos precisos de prevalencia de la enfermedad a nivel nacional en esta especie.
| Los datos obtenidos a nivel regional en zonas del centro y sur de la península han mostrado una elevada prevalencia al inicio de estos programas, como es el ejemplo más reciente de Andalucía o Castilla-La Mancha3,4. |
Los primeros años de implementación de estos programas han supuesto un esfuerzo económico considerable por parte de la administración y los ganaderos, pero queda justificado por el ya demostrado éxito de algunos programas:
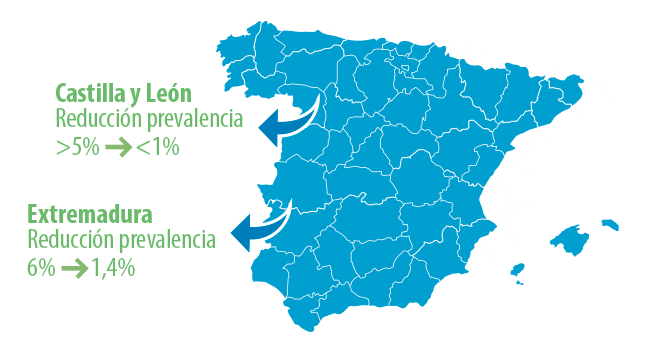
![]() En Castilla y León se redujo la prevalencia desde más de un 5% a menos del 1% en un periodo menor a 10 años5.
En Castilla y León se redujo la prevalencia desde más de un 5% a menos del 1% en un periodo menor a 10 años5.
![]() En Extremadura, la prevalencia de rebaños era del 6% en 2017 y seis años más tarde, en 2022, había descendido al 1,4%6.
En Extremadura, la prevalencia de rebaños era del 6% en 2017 y seis años más tarde, en 2022, había descendido al 1,4%6.
Otras Comunidades Autónomas que también han implementado programas de erradicación de tuberculosis en ganado caprino son Aragón, Asturias, Baleares, Cataluña, la Región de Murcia y la Comunidad Valenciana2.
| A pesar de que no hay datos a nivel nacional y aún quedan muchas zonas en las que se desconoce la situación de la enfermedad en ganado caprino y su papel en el mantenimiento de la tuberculosis en otras especies, la imagen de la incidencia y prevalencia de la tuberculosis caprina va ganando mayor definición. |
TÉCNICAS DE DIAGNÓSTICO DE LA TUBERCULOSIS CAPRINA
Existe disparidad entre los programas autonómicos de erradicación de la tuberculosis caprina en cuanto a la obligatoriedad y la presión diagnóstica. No obstante, estos programas se basan principalmente en:
1. El diagnóstico ante-mortem mediante la prueba de la intradermotuberculinización simple (IDTBs) o comparada (IDTBc).
2. El sacrificio de los animales reactores, empleando normalmente la misma metodología e interpretación recomendada en bovino.
DIAGNÓSTICO ANTE-MORTEM
Intradermotuberculinización
La IDTB, pese tener una sensibilidad limitada7, ha demostrado su eficacia al reducir drásticamente la prevalencia en periodos cortos de tiempo en los programas de erradicación autonómicos.
En la mayoría de las Comunidades Autónomas se emplea:
|
 |
No obstante, la estrategia e interpretación de las pruebas varía entre Comunidades Autónomas en función de si se quiere incrementar la sensibilidad o la especificidad. |
Prueba de detección de interferón-gamma (IFN-γ)
Otra prueba de base celular empleada de rutina en el ganado bovino es la prueba de detección de interferón-gamma (IFN-γ).
En el ganado caprino esta prueba se ha empleado de forma puntual en algunos estudios de investigación o de forma específica en el control de algunos brotes, pero no es una técnica incluida de forma rutinaria en los programas de erradicación.
![]() Presenta una mayor sensibilidad y elimina el carácter subjetivo de la IDTB.
Presenta una mayor sensibilidad y elimina el carácter subjetivo de la IDTB.
![]() Requiere una mayor infraestructura, costes de laboratorio y personal especializado.
Requiere una mayor infraestructura, costes de laboratorio y personal especializado.
Pruebas serológicas
En los últimos años, las pruebas serológicas de detección de anticuerpos como ELISA han demostrado ser una técnica complementaria eficaz y de coste aceptable en esta especie, pudiendo usarse tanto muestras de suero8-10 como de leche11,12.
Asimismo, otros tests rápidos de detección de anticuerpos con una sensibilidad menor pero complementaria a las pruebas de base celular han sido evaluados en ganado bovino y fauna silvestre13,14. Sin embargo, su uso individual en el marco de estos programas a gran escala supone unos costes difícilmente asumibles.
PERSPECTIVAS DE FUTURO EN EL DIAGNÓSTICO DE LA TUBERCULOSIS CAPRINA
De forma similar al ganado bovino, la mejora del diagnóstico ante-mortem pasa por dos puntos clave:
| 1. El desarrollo nuevas técnicas y la optimización de las técnicas actuales.
2. El desarrollo de nuevos antígenos que mejoren y sustituyan a las tuberculinas o PPDs (derivado proteico purificado). |
Los nuevos antígenos basados en proteínas recombinantes o proteínas fusión han demostrado una alta especificidad y su utilidad como antígenos DIVA en animales vacunados con BCG. Sin embargo, todavía son necesarios estudios de campo que demuestren una sensibilidad equiparable a las PPDs15,16. |
Nuevos antígenos – Proyecto europeo imdiTBap
En relación al desarrollo de nuevos antígenos, actualmente se encuentra en marcha el proyecto europeo imdiTBap17, coordinado por el Centro de Vigilancia Sanitaria Veterinaria de la Universidad Complutense de Madrid (VISAVET) que está evaluando el rendimiento diagnóstico de dos nuevos antígenos (DST-F y P22) a gran escala en pruebas de base celular y humoral en estudios de campo en bovinos, caprinos y búfalos en distintos países.
| Concretamente, en este proyecto se están evaluando estos nuevos antígenos en:
|
La prueba de detección multicitoquinas también puede suponer una mejora sustancial del diagnóstico mediante la búsqueda de nuevos biomarcadores que complementen la detección del IFN-γ18. |
 Los resultados preliminares de este proyecto en ganado caprino sugieren una sensibilidad de estos antígenos similar a las PPDs en el IGRA y una elevada sensibilidad del ELISA empleando el antígeno P22. Los resultados preliminares de este proyecto en ganado caprino sugieren una sensibilidad de estos antígenos similar a las PPDs en el IGRA y una elevada sensibilidad del ELISA empleando el antígeno P22. |
Caracterización de las PPDs
La caracterización de las PPD utilizadas en los programas de erradicación es otro pilar fundamental a mejorar.
 Actualmente, únicamente se evalúa su potencia biológica para su validación y uso en campo mediante una prueba en cobayas con una reproducibilidad limitada, unos costes elevados y un problema ético por la gran cantidad de animales necesarios.
Actualmente, únicamente se evalúa su potencia biológica para su validación y uso en campo mediante una prueba en cobayas con una reproducibilidad limitada, unos costes elevados y un problema ético por la gran cantidad de animales necesarios.
La composición de las PPDs es compleja, ligada principalmente a su modo de obtención, como han demostrado estudios de proteómica19.
Tienen la problemática de que comparten muchas proteínas con otras micobacterias ambientales, por lo que la caracterización de las PPDs y la determinación de sus antígenos más inmunogénicos y específicos es vital para seleccionar las PPDs más óptimas y mejorar el rendimiento de las técnicas diagnósticas.
| Algunos avances se han logrado en este sentido, como es el caso de P22, un complejo proteico más específico e inmunogénico obtenido a partir de la inmunopurificación de la PPD bovina20. |
Metodologías emergentes para el diagnóstico ante-mortem
 Existen otras plataformas o metodologías emergentes de potencial aplicación en el campo del diagnóstico ante-mortem de la tuberculosis animal que actualmente se encuentran en fase de desarrollo y todavía presentan costes elevados.
Existen otras plataformas o metodologías emergentes de potencial aplicación en el campo del diagnóstico ante-mortem de la tuberculosis animal que actualmente se encuentran en fase de desarrollo y todavía presentan costes elevados.
 Algunas de estas plataformas han reducido considerablemente sus costes en los últimos años, como es el caso de la espectroscopía de resonancia magnética nuclear de sobremesa (de campo bajo) que, en estudios recientes, ha permitido discriminar correctamente bovinos y caprinos infectados y no infectados con tuberculosis en base al perfil de metabolitos en plasma21,22.
Algunas de estas plataformas han reducido considerablemente sus costes en los últimos años, como es el caso de la espectroscopía de resonancia magnética nuclear de sobremesa (de campo bajo) que, en estudios recientes, ha permitido discriminar correctamente bovinos y caprinos infectados y no infectados con tuberculosis en base al perfil de metabolitos en plasma21,22.
Métodos de detección directa in vivo de micobacterias
Se han evaluado algunos métodos de diagnóstico directo del agente causal in vivo, mostrando con una sensibilidad significativamente menor que las técnicas inmunológicas.
 Un ejemplo relativamente reciente es el empleo de fagos en combinación con PCR para detectar micobacterias tuberculosas viables en sangre23. Un ejemplo relativamente reciente es el empleo de fagos en combinación con PCR para detectar micobacterias tuberculosas viables en sangre23.
Sin embargo |
| Del mismo modo, el empleo de una PCR directa en sangre de bovino también ha demostrado una sensibilidad muy limitada (menos del 30% en animales confirmados con tuberculosis en el diagnóstico post-mortem) 25. |
| Las muestras ambientales empleadas para la detección de ADN de micobacterias tuberculosas también han demostrado utilidad en estudios epidemiológicos a nivel de rebaño para confirmar la infección, por ejemplo, utilizando un sistema de esponjas hidratadas en un medio de inactivación en puntos de interacción entre especies (ej. puntos de agua y comida)26. |
| Otros métodos indirectos más complejos como, por ejemplo, el estudio de los compuestos orgánicos volátiles (COV)27, se encuentran en una fase más experimental, pero pueden ser una herramienta útil en el futuro del diagnóstico de la tuberculosis y otras enfermedades infecciosas.
|
 El rendimiento de las técnicas de diagnóstico y su frecuencia e interpretación son puntos clave en los programas de erradicación de tuberculosis. Las pruebas de diagnóstico actuales han permitido controlar y erradicar la tuberculosis animal en algunas regiones del mundo. El rendimiento de las técnicas de diagnóstico y su frecuencia e interpretación son puntos clave en los programas de erradicación de tuberculosis. Las pruebas de diagnóstico actuales han permitido controlar y erradicar la tuberculosis animal en algunas regiones del mundo. |
No obstante, éstas no están exentas de limitaciones y es imprescindible seguir trabajando en la mejora de las mismas y el desarrollo de nuevas técnicas enfocadas a las diferentes especies domésticas y silvestres implicadas, con el fin de acelerar la erradicación de la enfermedad en regiones con una situación epidemiológica compleja.
BIBLIOGRAFÍA
1. Eurostat. 2021. https://ec.europa.eu/eurostat/web/products-eurostat-news/-/ddn-20220517-2
2. Ministerio de Agricultura, Pesca y Alimentación (MAPA). Manual para el control de la infección por el CMT en establecimientos de ganado caprino incluidos en el programa nacional de erradicación de la infección por el complejo Mycobacterium tuberculosis (MT) 2024.
3. https://www.mapa.gob.es/es/ganaderia/temas/sanidad-animal-higiene-ganadera/8manualcaprino2024_tcm30-553693.pdf
4. Jiménez-Martín D, García-Bocanegra I, Risalde MA, Napp S, Domínguez M, Romero B, et al. Mycobacterium tuberculosis complex in domestic goats in Southern Spain. Prev Vet Med. 2024. 227:106204.
5. Consejería de Agricultura GyDRRd, de la Dirección General de Ordenación Agropecuaria, por la que se desarrollan determinados aspectos de los programas nacionales de control, vigilancia y erradicación de enfermedades animales para el año 2024, en la Comunidad Autónoma de Castilla-La Mancha. [2024/122].
6. Junta de Castilla y León. Agricultura y Ganadería. Tuberculosis Bovina. https://agriculturaganaderia.jcyl.es/web/es/ganaderia/tuberculosis-bovina.html.
7. Diario Oficial de Extremadura CdA, Desarrollo Rural, Población y Territorio. Resolución de 15 de junio de 2023, de la Dirección General de Agricultura y Ganadería, por la que se declaran áreas de especial incidencia en tuberculosis bovina, así como otras medidas de sanidad animal en tuberculosis caprina, en brucelosis en rumiantes, y en determinados espacios cinegéticos, en la Comunidad Autónoma de Extremadura.
8. Roy A, Infantes-Lorenzo JA, de la Cruz ML, Domínguez L, Álvarez J, Bezos J. Accuracy of tuberculosis diagnostic tests in small ruminants: A systematic review and meta-analysis. Prev Vet Med. 2020. 182:105102.
9. Bezos J, Roy Á, Infantes-Lorenzo JA, González I, Venteo Á, Romero B, et al. The use of serological tests in combination with the intradermal tuberculin test maximizes the detection of tuberculosis infected goats. Vet Immunol Immunopathol. 2018. 199:43-52.
10. Infantes-Lorenzo JA, Moreno I, Roy A, Risalde MA, Balseiro A, de Juan L, et al. Specificity of serological test for detection of tuberculosis in cattle, goats, sheep and pigs under different epidemiological situations. BMC Vet Res. 2019. 15:70.
11. O’Brien A, Whelan C, Clarke JB, Hayton A, Watt NJ, Harkiss GD. Serological Analysis of Tuberculosis in Goats by Use of the Enferplex Caprine TB Multiplex Test. Clin Vaccine Immunol. 2017. 24.
12. Roy A, Infantes-Lorenzo JA, Domínguez M, Moreno I, Pérez M, García N, et al. Evaluation of a new enzyme-linked immunosorbent assay for the diagnosis of tuberculosis in goat milk. Res Vet Sci. 2020.128:217-23.
13. Velasco C, Ortega J, Ricón J, Romero B, de Juan L, Domínguez L, et al. Effect of a recent intradermal test on the specificity of P22 ELISA for the diagnosis of caprine tuberculosis. Front Vet Sci. 2024. 11:1358413.
14. Waters WR, Vordermeier HM, Rhodes S, Khatri B, Palmer MV, Maggioli MF, et al. Potential for rapid antibody detection to identify tuberculous cattle with non-reactive tuberculin skin test results. BMC Vet Res. 2017. 13:164.
15. Sridhara AA, Johnathan-Lee A, Elahi R, Lambotte P, Esfandiari J, Boschiroli ML, et al. Differential detection of IgM and IgG antibodies to chimeric antigens in bovine tuberculosis. Vet Immunol Immunopathol. 2022. 253:110499.
16. Middleton S, Steinbach S, Coad M, McGill K, Brady C, Duignan A, et al. A molecularly defined skin test reagent for the diagnosis of bovine tuberculosis compatible with vaccination against Johne’s Disease. Sci Rep. 2021. 11:2929.
17. Jones GJ, Konold T, Hurley S, Holder T, Steinbach S, Coad M, et al. Test performance data demonstrates utility of a cattle DIVA skin test reagent (DST-F) compatible with BCG vaccination. Sci Rep. 2022. 12:12052.
18. Velasco C, Roy Á, Ortega J, Romero B, Álvarez J, Domínguez M, Moreno I, Díez-Guerrier A, de Juan L, Domínguez L, Bezos J. 2024. rumiNews. Mejorando el diagnóstico para ayudar en la erradicación de la tuberculosis en los rumiantes domésticos: El proyecto internacional imdiTBap. https://rumiantes.com/mejorando-el-diagnostico-para-ayudar-en-la-erradicacion-de-latuberculosis-en-los-rumiantes-domesticos-el-proyecto-internacional-imditbap/.
19. Coad M, Doyle M, Steinbach S, Gormley E, Vordermeier M, Jones G. Simultaneous measurement of antigen-induced CXCL10 and IFN-γ enhances test sensitivity for bovine TB detection in cattle. Vet Microbiol. 2019. 230:1-6.
20. Prasad TS, Verma R, Kumar S, Nirujogi RS, Sathe GJ, Madugundu AK, et al. Proteomic analysis of purified protein derivative of Mycobacterium tuberculosis. Clin Proteomics. 2013. 10:8.
21. Infantes-Lorenzo JA, Moreno I, Risalde M, Roy Á, Villar M, Romero B, et al. Proteomic characterisation of bovine and avian purified protein derivatives and identification of specific antigens for serodiagnosis of bovine tuberculosis. Clin Proteomics. 2017. 14:36.
22. Ruiz-Cabello J, Sevilla IA, Olaizola E, Bezos J, Miguel-Coello AB, Muñoz-Mendoza M, et al. Benchtop nuclear magnetic resonance-based metabolomic approach for the diagnosis of bovine tuberculosis. Transbound Emerg Dis. 2022. 69:e859-e70.
23. Alonso-Moreno P. OJ, Velasco-Reinaldos C., Lopez A., Izquierdo-García JL. y Bezos J. Metabolómica aplicada al diagnóstico de la tuberculosis caprina, ¿funciona?. XXVI Edición del Simposio Nacional AVEDILA, Asociación de Veterinarios Especialistas en Diagnóstico de Laboratorio, Elche, España, 20 de noviembre de 2023. Comunicación oral.
24. Swift BMC, Meade N, Barron ES, Bennett M, Perehenic T, Hughes V, et al. The development and use of Actiphage(®) to detect viable mycobacteria from bovine tuberculosis and Johne’s disease-infected animals. Microb Biotechnol. 2020. 13:738-46.
25. Ortega J. BA, Roy A., Lorente-Leal V., Vinolo C., Romero B., de Juan L., Infantes-Lorenzo JA. y Bezos J. Evaluación de una nueva técnica diagnóstica ante-mortem de tuberculosis en ganado caprino: Actiphage Rapid. XXIV Edición del Simposio AVEDILA, Asociación de Veterinarios Especialistas en Diagnóstico de Laboratorio, Pamplona, España, 8 de noviembre de 2019. Comunicación oral.
26. Encinas M, Ferrara Muñiz X, Sammarruco RA, Ruiz Menna V, Garro CJ, Delgado F, et al. Limited usefulness of the IS6110 touchdown-PCR in blood for tuberculin skin test false-negative cattle with serological response to Mycobacterium bovis. Front Vet Sci. 2024. 11:1359205.
27. Martínez-Guijosa J, Romero B, Infantes-Lorenzo JA, Díez E, Boadella M, Balseiro A, et al. Environmental DNA: A promising factor for tuberculosis risk assessment in multi-host settings. PLoS One. 2020. 15:e0233837.
28. Rodríguez-Hernández P, Rodríguez-Estévez V, Arce L, Gómez-Laguna J. Application of Volatilome Analysis to the Diagnosis of Mycobacteria Infection in Livestock. Front Vet Sci. 2021. 8:635155.
29. Rodríguez-Hernández P, Cardador MJ, Ríos-Reina R, Sánchez-Carvajal JM, Galán-Relaño Á, Jurado-Martos F, et al. Detection of Mycobacterium tuberculosis complex field infections in cattle using fecal volatile organic compound analysis through gas chromatography-ion mobility spectrometry combined with chemometrics. Microbiol Spectr. 2023. 11:e0174323.





 Latinoamérica
Latinoamérica
 Europa
Europa